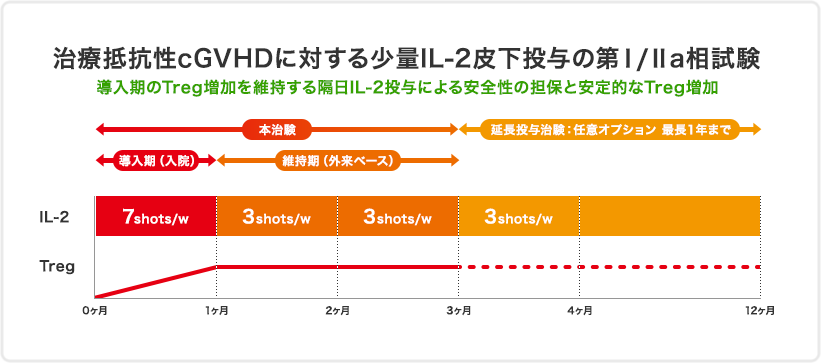
本治験では治験は18歳以上のステロイドに反応の乏しい慢性GVHDの患者さんに対し、低用量IL-2を導入期(4週間、連日投与)と維持期(8週間、隔日投与)の計12週間投与し有効性と安全性を検討します。
治験課題名:
治療抵抗性慢性移植片対宿主病に対する低用量インターロイキン(IL-2)皮下投与の第Ⅰ/Ⅱa相治験
主要評価項目:
① IL-2皮下投与の4週間投与時の最大耐量(MTD:maximum tolerated dose)の決定
② 3ヶ月の治療効果維持生存率(Failulre Free Surival; FFS)を指標とする有効性の検討
副次評価項目:
① IL-2皮下投与の12週間におけるCTCAE ver. 4.0に基づく安全性の検討
② NIH治療効果判定基準、及びステロイド減量効果に基づく臨床効果の検討
③ IL-2皮下投与の制御性T細胞数の増加を指標とした免疫学的効果の検討
治験デザイン
多施設共同一般臨床試験(オープンラベル試験)
選択・除外基準
対象
ステロイド不応性/不耐性の慢性GVHD患者
選択基準
- 骨髄破壊的又は骨髄非破壊的な前処置法による同種造血幹細胞移植を受けた患者
- 移植日から180日以上が経過した患者
- ステロイド治療に不応性または不耐性の慢性移植片対宿主病(慢性GVHD)#1の患者
#1:過去にプレドニゾロン相当量として1.0mg/kg 連日2週, 0.5mg/kg 連日4週, 1.0mg/kg 隔日4週 のいずれかの治療に反応がない、あるいは継続困難な患者。慢性GVHDの広範型/限局型の別、また重症度分類、障害臓器を問わない。 - 登録前2週間は,ステロイドの投与量を変更していない患者
- 登録前4週間は,他の免疫抑制剤(カルシニューリン阻害剤,シロリムス,ミコフェノール酸モフェチル)の追加投与,投与量の変更,中止がなされていない患者.ただし,カルシニューリン阻害薬については,カルテに記載された目標血中濃度に応じた承認用法・用量内の調節は許容される.
- 主要臓器に重篤な機能障害がない患者(登録前の同一日の検査値)
- 成長因子投与又は輸血されていない状態にて,以下の骨髄機能を有すること
-
- 絶対好中球数(ANC:absolute neutrophil count)>1000/mm3
- 血小板数 > 50,000/mm3
- 総リンパ球数>400/mm3
- AST #2 < 2×施設基準正常上限
- 総ビリルビン#2 < 2.0 mg/dl
- クレアチニン[Cr]#3 < 2×施設基準正常上限
#2. 肝機能検査(LFT:liver function test)異常が活動性慢性GVHDによるものであり,他の原因を否定できる場合は,登録可能である.ただし,肝機能異常が活動性慢性GVHDの唯一の症状である患者は,治験登録前に肝生検でGVHDを診断することを必須とする.
#3. 米国で関連臨床試験において、腎機能低下症例においてIL-2投与後に重篤な血栓性微小血管障害(TMA:thrombotic microangiopathy)の発症が報告されている。
- 同意取得日の年齢が,18歳以上の患者
- 生殖能のある男性又は女性は,本治験の投与期間中及び投与完了後6ヶ月間にわたって適切な避妊を実施することが可能な(同意した)患者
- 自らの自由意思で治験参加の同意を書面で取得可能な患者,20歳未満の被験者の場合には,被験者自身に加え,代諾者(被験者の両親或いは法定代理人等)の同意を署名で取得すること.
除外基準
- 投与中のコルチコステロイド量がプレドニゾロン相当量として1 mg/kg/日を上回る患者
- 登録前4週間に以下の薬剤を慢性GVHD治療の目的で投与された患者
- TNFa阻害剤
- ボルテゾミブ
- 抗CD 20 抗体(リツキシマブ)
- イマチニブ(但し、Ph-ALL移植後の維持療法としてcGVHD発症前から投与されている症例は、これを除外しない)
- 登録前4週間に以下の試験的治療を実施した患者
- ECP療法(体外循環式光化学療法:extracorporeal photopheresis)
- UV療法(紫外線/光線:Ultraviolet)
- タミバロテン内服
- その他の試験的治療
- 登録前180日間に以下の薬剤を使用した患者
- 抗胸腺細胞グロブリン(antithymocyte globulin,ATG)
- 抗CD52抗体(Alemtuzumab)
- 抗CD 3抗体(OKT 3)
- 抗CCR 4抗体(Mogamulizumab)
- 抗CD 25 抗体(Basiliximab、denileukin diffitox)
- 抗CD 30 抗体(brentuximab vedotin)
- 抗PD-1抗体
- 抗PD-L1抗体
- このほか、制御性T細胞の動態に影響を与えると考えられる抗体医薬
- 活動性悪性疾患の再発が疑われる患者
- 活動性感染症のコントロールが不良であると主治医により判断される患者
- 余命が3ヶ月間未満であると予想される患者
- 妊婦又は授乳婦
- IL-2投与の来院スケジュールを遵守できない患者
- コントロール不良の狭心症又は症候性うっ血性心不全(NYHA分類III又はIV)の既往または合併している患者(NYHA:New York Heart Association)
- 臓器移植(同種移植片)のレシピエントである患者
- HLA-A, B, DRの血清型6座で2座以上不適合であるドナーより移植を受けた患者(ただし,臍帯血移植におけるHLA 2 座以上不適合は,これを除外しない)
- CTCAE Grade3以上の不安定狭心症,心筋梗塞、深部静脈血栓症、脳梗塞の既往のある患者
- 抗凝固療法中の患者
- 移植急性期に重症のTMA(破砕赤血球が見られ,血清クレアチニン値が正常上限の2倍を越える上昇を伴う)の既往がある患者
- 原疾患が、IL-2受容体であるCD25を発現する血液腫瘍である症例
- この他、主治医により本治験に適さないと判断される患者
有害事象・費用負担
過去に米国で施行された類似の臨床試験では、以下に挙げる有害事象が報告されました。本試験においては、これらの点に十分に配慮し、慎重に治療を進めるとともに、もし有害事象が発生した場合は速やかに適切な対処を行います。
- 注射部位反応
- 発熱・インフルエンザ様症状
- 血球減少
- 血栓性微小血管障害症(thrombotic microangiopathy: TMA)
- 心・血管合併症
- 甲状腺機能障害
- 感染症
この治験にご参加いただいている期間、治験薬は製薬会社から無償で提供されます。
それ以外の基本診療料や検査費・通常使用されている薬剤等の費用は、健康保険の範囲で、従来通り 患者さんご自身にご負担頂きます。
実施場所
現在、以下の施設で治験が実施されています。
札幌市
東京都
千葉市
名古屋市
枚方市
岡山市
松山市
東京都
千葉市
名古屋市
枚方市
岡山市
松山市
福岡市
登録期間
2015年4月~